Claudio Della Volpe
Nella prima parte di questo post abbiamo esaminato un paio di casi non comuni di identità chimico-molecolare non legati semplicemente alla formula della sostanza e abbiamo visto che la distinzione naturale-sintetico può essere molto complessa (o come dice Scientific American una zona grigia)
Lo abbiamo fatto perché a me appare superata la polemica stucchevole fra chemofobici (che vogliono materiali chemical free) e chemofilici (che fanno cherry picking fra i vari casi di sostanze di sintesi più pure e quindi meno allergeniche o tossiche, oppure che fanno notare come i veleni più potenti per unità di massa siano naturali non sintetici, la tossina del botulino LD50 di 1ng/kg di peso); nonostante questo impegno la fallimentare strategia chemofilica non impedisce la nascita, la crescita e il prosperare di una pseudo-bio-filosofia chemofobica.
Personalmente ritengo che la strategia chemofilica sia sbagliata anche perché non è affatto vero che i composti naturali e sintetici con la medesima formula chimica siano identici: lo sono per la loro formula, lo sono per i loro effetti pratici, lo sono funzionalmente, ma non lo sono necessariamente all’occhio del chimico (non chemofilico, né tanto meno chemofobico).
Il caso del para e orto idrogeno chiarisce bene una cosa: la formula chimica tradizionale che esprime solo numero atomico e legame chimico non dice tutto, è una approssimazione; la dimostrazione è nel fatto che orto- e para-idrogeno hanno non solo proprietà fisiche diverse, come temperatura di transizione di fase o entalpia di transizione, ma anche diversa reattività chimica. La cosa è manifesta a bassa temperatura, per esempio nelle nubi interstellari, argomento dell’astrochimica.( DOI: 10.1038/NCHEM.2359)
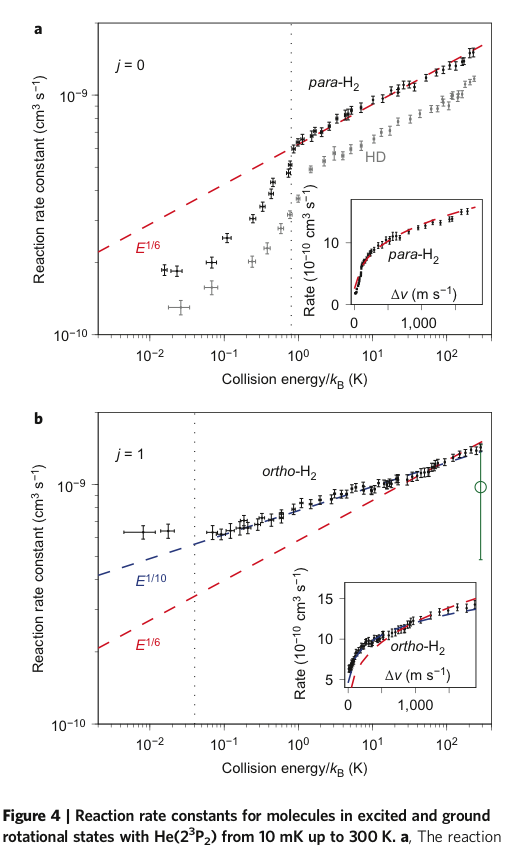 Le costanti di reazione delle due molecole sono diverse a bassa temperatura e diventano ben sovrapponibili solo sopra i 30K; nello spazio interstellare la chimica dell’idrogeno è divisa dunque fra quella del paraidrogeno e quella dell’ortoidrogeno: studi sono ancora in corso.
Le costanti di reazione delle due molecole sono diverse a bassa temperatura e diventano ben sovrapponibili solo sopra i 30K; nello spazio interstellare la chimica dell’idrogeno è divisa dunque fra quella del paraidrogeno e quella dell’ortoidrogeno: studi sono ancora in corso.
Ma questo potrebbe essere considerato un caso estremo; consideriamo allora esempi più semplici e generali di identità molecolare: quali differenze possiamo attribuire a composti o sostanze (quindi miscele di composti) di origine naturale o sintetica con la medesima formula?
Non stiamo parlando di singole molecole, ma di composti o sostanze in quantità macroscopica: la chimica è una scienza macroscopica, nel caso generale, e ha a che fare con grandi numeri di molecole o atomi.
Le differenze si possono ascrivere a
- diversa purezza quantitativa e diversa composizione delle impurezze, prodotte da reazioni del tutto diverse nei due casi; questo costituisce una sorta di marchio indelebile della sostanza o del composto, anche a parità di costituzione delle singole molecole; è infatti impossibile avere una purezza del 100%, almeno al momento.
- diversa composizione isotopica del composto; questo può manifestarsi sotto forma di isotopologia (un atomo qualunque è di diverso tipo isotopico) o sotto forma di isotopomeria (ossia un medesimo atomo e sempre quello è sostituito da isotopi diversi); va da se che una molecola isotopomera di un’altra è anche una sua isotopologa; il viceversa non è dato.
- diverso stato magnetico del nucleo come è il caso di para- ed orto-idrogeno, fenomeno che corrisponde ad isomeria di spin e che genera livelli energetici diversi e diverse reattività.
Ciascuno di questi casi presenta molti esempi e corrisponde in genere ad una medesima “formula” chimica, pur in presenza di diversità macroscopiche del materiale. Ovviamente alcuni isotopi hanno un proprio simbolo e si può sempre indicare il numero di nucleoni, il numero di massa A, 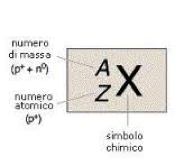 a fianco al simbolo, ma comunemente questo non viene fatto con sistematicità.
a fianco al simbolo, ma comunemente questo non viene fatto con sistematicità.
Le distinzioni di identità sono talmente forti da dare luogo a metodi sperimentali ben acclarati o tabulati, a norme precise con effetti legali per distinguere fra diverse origini del composto o della sostanza.
Cominciamo dal caso più banale; come distinguere genericamente una sostanza organica sintetica o naturale? Le sostanze naturali organiche vengono da un pool di atomi di carbonio che scambia regolarmente con l’atmosfera; gli atomi di carbonio dell’atmosfera sono soggetti ai raggi cosmici e dunque danno luogo a reazioni nucleari che producono quantità macroscopiche di 14C; viceversa i materiali sintetici vengono nella stragrande maggioranza da un pool di atomi di carbonio residente fuori dall’atmosfera da molto tempo (carbone, petrolio, gas naturale) protetto dai raggi cosmici e in cui dunque la quota di 14C si è ridotta (esiste una tecnica di datazione isotopica basata su questo fenomeno) oppure è scomparsa; ne segue che le sostanze o i composti sintetici sono genericamente meno radioattivi di quelli naturali. Stessa formula, diversa composizione isotopica, molecole isotopologhe o isotopomere; l’alcool etilico sintetico e quello naturale per esempio sono così diversi da poter essere distinti applicando le procedure stabilite dal metodo ASTM D6866-05 basato proprio su questo fenomeno di decadimento radioattivo.
D’altronde l’effetto isotopico fra i due atomi è significativo; la differenza di velocità nella polimerizzazione fra monomeri di stirene contenenti questi due isotopi è dell’ordine del 10%. Non si tratta solo di radioattività, ma proprio di chimica, di reattività.
Tuttavia anche se usassimo monomeri di stirene ottenuti da materiale naturale avremmo reazioni di polimerizzazione dello stirene di un 10% più lente solo per la quota di 14C (che è troppo piccola per avere effetti macroscopici). La conseguente chimica verde sarebbe più lenta di quella normale, sintetica, ma per una quantità troppo piccola per essere attualmente misurata (ringrazio il collega Ragaini di avermi fatto notare un errore nel mio ragionamento).
Questo potrebbe far pensare che le differenze isotopiche e dunque fra isotopomeri e isotopologhi abbiano solo un ruolo analitico; in Natura avvviene però che le piante (e dunque i loro enzimi) siano di fatto in grado di distinguere; per esempio piante cosiddette C3 e C4, dotate di diversi meccanismi di fotosintesi, hanno un rapporto fra 12C e 13C diverso nei loro tessuti e questo vuol dire che i loro enzimi sono in grado di discriminare fra isotopi (si noti che questi sono isotopi stabili); una conseguenza chimica di questo è che isotopomeri o isotopologhi diversi hanno diversa reattività e che i sistemi biologici sono in grado di discriminare; anche se al momento non abbiamo esempi tecnologici di questo, inventati da noi (se non di tipo analitico) la differenza di principio rimane.
Passiamo al problema delle impurezze; l’urea è stata la prima molecola naturale ottenuta per via sintetica; è una storia di errori e serendipità. Wholer voleva sintetizzare il cianato di ammonio, (che ha una formula bruta uguale all’urea) NH4OCN, ma per riscaldamento il cianato da lui ottenuto per doppio scambio a partire da cianato di argento e cloruro di ammonio si trasformò in urea e dunque la sua sintesi non riuscì, ma produsse un risultato così eclatante da essere poi la base della moderna chimica di sintesi. Viva gli errori!
La sintesi commerciale dell’urea si ottiene oggi in vari modi, ma in ogni caso una percentuale significativa di biureto è presente nel prodotto commerciale; il biureto è un prodotto che deriva dalla condensazione di due molecole di urea ad alta temperatura, NH2-CO-NH-CO-NH2, e può avere effetti deleteri su alcune piante se si utilizza l’urea con troppo biureto come concime (http://fshs.org/proceedings-o/1954-vol-67/67-69%20%28OBERBACHER%29.pdf)
L’urea estratta dall’urina umana o animale, viceversa, non contiene affatto biureto come impurezza, per cui la ricerca del biureto potrebbe costituire un semplice metodo per distinguere l’urea sintetica da quella naturale.
Tuttavia è chiaro che si possono ridurre, sia pur faticosamente e costosamente, le impurezze al di sotto di una soglia qualsivoglia, fare scomparire insomma i residui indesiderati.
Ma tornando all’urea, nonostante la purificazione rimane qualche segno della diversa origine delle molecole di urea? La risposta è positiva. Si tratta della cosiddetta impronta isotopica. In genere sembra ci sia più 15N nell’urea naturale, ma la questione è complessa ed un’analisi dettagliata della questione potete trovarla in letteratura (https://wwwrcamnl.wr.usgs.gov/isoig/isopubs/itchch16.html).
La diversa impronta isotopica di materiali di differente origine va molto al di là della distinzione naturale/sintetico poichè consente, per esempio, di risalire all’origine di un prodotto e facilita la sua geolocalizzazione. La geochimica e in genere le scienze ambientali sono grandi utilizzatrici di questi metodi. Quindi non solo naturale o sintetico, ma fatto in un certo modo o in un certo posto; le molecole che pure sembrano uguali nella formula e nella accesa polemica anti-chemofobica, si rivelano poi alquanto diverse e memori della loro origine e della loro storia nella realtà dell’analisi chimica: le molecole sono glocali, globali nella formula, locali nei dettagli.
Una interessante considerazione potrebbe essere quella di capire se in genere sia possibile al di là dei casi di diversa origine del medesimo composto capire con qualche criterio se un prodotto sia di origine naturale o sintetica, cioè se esso esista in natura prima della nostra sintesi o no; il chemical space di cui abbiamo ripetutamente parlato nel blog è costituito oggi di oltre cento milioni di molecole(108), ma potenzialmente tale numero è strabocchevole (1060): come distinguere ora e in futuro l’origine dei composti? Una proposta ci viene dall’uso dei metodi dei descrittori molecolari (di cui pure abbiamo parlato nel blog) con capacità di distinzione che superano il 90% da parte di programmi automatici (J. Chem. Inf. Comput. Sci. 2000, 40, 1245-1252).
Termino con una informazione; l’acqua possiede due isomeri di spin separabili, dunque due molecole del tutto identiche secondo i criteri normali ma separabili come tali e conservabili a -18°C per qualche settimana; cosa facciamo, vietiamo la notizia ai supporters dell’omeopatia? (SCIENCE VOL 296 28 JUNE 2002) Aggiungo che il solito russo genialoide propone una idea teorica anomala: (Biofizika. 2013 Sep-Oct;58(5):904-9. S.D. Zakharov) sappiamo che l’acqua comune è una miscela di due quasi fasi definite comunemente acqua strutturata tipo ghiaccio e acqua destrutturata (è acclarato almeno dagli anni 60 il sito che vi linko è quello celeberrimo di Martin Chaplin); Zakharov ipotizza che le strutture tipo ghiaccio siano strutture di para-acqua legate in cluster chiusi, per spiegarne la nulla libertà di rotazione, mentre la ortoacqua sarebbe invece l’acqua destrutturata; l’idea è intrigante. L’abstract è in inglese, ma l’articolo è in russo.
Aggiungo che il solito russo genialoide propone una idea teorica anomala: (Biofizika. 2013 Sep-Oct;58(5):904-9. S.D. Zakharov) sappiamo che l’acqua comune è una miscela di due quasi fasi definite comunemente acqua strutturata tipo ghiaccio e acqua destrutturata (è acclarato almeno dagli anni 60 il sito che vi linko è quello celeberrimo di Martin Chaplin); Zakharov ipotizza che le strutture tipo ghiaccio siano strutture di para-acqua legate in cluster chiusi, per spiegarne la nulla libertà di rotazione, mentre la ortoacqua sarebbe invece l’acqua destrutturata; l’idea è intrigante. L’abstract è in inglese, ma l’articolo è in russo.
Mentre la fisica scopre un’universo in cui la materia oscura domina quella normale 6:1 noi ci crogioliamo in una descrizione dell’identità molecolare basata solo su numero atomico e legame chimico, la formula tradizionale; Montalbano direbbe: “mi sono pirsuaso che le vostre carte di identità sono scadute, signore molecole!”.
Naturale o sintetico è una polemica che non mi appassiona, si sarà capito; la chimica moderna ha dimostrato con le sue sofisticate tecniche analitiche che è possibile risalire all’origine e perfino al luogo o alle reazioni di formazione di un composto o di una sostanza; certo l’uso delle formule ci consente di schematizzare potentemente il numero atomico Z e i legami di un composto ,ma nella realtà dell’analisi si potrà poi andare oltre e perfino in alcuni casi determinare l’origine e distinguere molecole affatto identiche, come nel caso di para e ortoidrogeno o di orto e para-acqua.
La materia non è fatta solo di nuvole elettroniche e per vedere l’albero si corre il rischio di perder di vista la foresta, come diceva il filosofo. Se abbiamo fallito finora nella lotta contro la chemofobia vale la pena di tentare nuove strade, nuovi approcci, in cui argomenti considerati “avanzati” siano usati e spiegati al “volgo profano”; in fondo naturale o sintetico è solo una questione di rischio/beneficio (non di costo/beneficio, ci sono rischi che non hanno prezzo).
Anche la distinzione fra specialisti e gli altri non mi appassiona; non ci sono argomenti per specialisti, c’è solo la scarsa tradizione a fare divulgazione, i chimici non hanno nemmeno un indirizzo di ricerca sulla didattica, un settore disciplinare che se ne occupi.
Sogno un mondo in cui la chimica sia conosciuta e amata da tutti, come un potente strumento di indagine e di sopravvivenza, che ci consenta però di essere più “umani” possibile; dopo tutto, la nostra specie conosce il fuoco (e dunque la chimica) da quando esiste.


Caro Della Volpe, apprezzo la stimolante discussione, ma c’è un errore riguardo alla velocità di polimerizzazione dello stirene “naturale” e “sintetico”. Il 10 % di differenza che citi si riferisce alla differente velocità di polimerizzazione dello stirene a normale distribuzione isotopica rispetto a quello 100% marcato con carbonio 14. Ma in natura il 14C è solo circa il 10 alla -12 % del carbonio totale. Anche assumendo che nello stirene sintetico non ci sia 14C, la differente velocità di reazione sarebbe del 10% sul 10 alla -12%. Il resto dello stirene polimerizzerebbe alla stessa velocità. Dubito che avremo mai metodi sperimentali di misurare una differenza di velocità dell’ordine del 10 alla -13%. In effetti potrebbe essere più rilevante il fatto che tra campioni di origine diversa ci sia una diversa composizione percentuale rispetto al 13C, ma i numeri e gli effetti che ne potrebbero derivare sono comunque molto piccoli. Non voglio fare il chemofilico radicale, ma mentre il discorso sulle impurezze è sicuramente valido, quello sulla differente reattività di molecole con la stessa formula chimica, ma diversa origine, mi sembra molto meno difendibile. La questione sul paraidrogeno è sicuramente corretta nelle basi scientifiche, ma qualunque farmaco rimarrà in una bottiglietta a temperatura ambiente un tempo sufficiente tra quando è stato preparato e quando viene assunto da annullare qualsiasi differenza ci potesse essere all’origine.
Fabio Ragaini (Università di Milano)
Sulla questione carbonio 14 nell’esempio fatto hai perfettamente ragione; errore mio e anche fesso. Modificato. Rimane tuttavia vero che esistono sistemi in grado di discriminare la reattività fra isotopologhi e isotopomeri, come nel caso della differenza fra piante C3 e C4 che ho aggiunto; non usiamo ancora questa “tecnologia” se non analiticamente ma in futuro chissà. Sull’altra questione il problema non è se ci sia un farmaco (non ho parlato proprio di farmaci) ma solo che le differenze di reattività chimica non corrispondono necessariamente nemmeno a differenze isotopiche; molecole perfettamente identiche per composizione isotopica e formula possono comunque avere differenze di reattività. Al momento gli esempi di differenze (limitati a orto e paraidrogeno) sono limitati alla astrochimica ma è un campo in crescita; i tempi di interconversione come citato sono dell’ordine di settimane o mesi in assenza di catalizzatore; e altre sostanze come para-acqua e orto-acqua potrebbero dare altre sorprese.
Dottore, la ringrazio anche per avermi spiegato la diversa reattività degli isotopi e spt le 2 forme a diverso grado di energia della molecola di idrogeno. Ma su questa diatriba non ci si può tirare indietro, perché si tratta di dire che una specie chimica (in purezza anche isotopica, ragionando per assurdo) é tale quale sia la sua provenienza vs l’argomentazione che l’estrazione “naturale” porta con se un plus intrinseco che attiene a connotazioni metafisiche. E la questione non sta nemmeno nelle impurezze che, lei m’insegna, esistono sia negli ambiti estrattivi che sintetici. Ovviamente uno é libero di credere che sia così ma non é che io per rispettare una sorta di credo panteista gli devo dare ragione. Anche la diversa reattività (potenziale, al momento per quel che capisco, e non é detto assuma significatività) di forme isotopiche diverse riguarda il livello di analisi dello stato chimico-fisico, mentre le attribuzioni di valore del “naturale” sono ideologiche. Altrimenti si rischia di offrire appigli FALSI a valutazioni che con la scienza nulla c’entrano ma riguardano altri ambiti, cui si puó credere con pieno diritto, ovviamente. Già é successo con la meccanica quantistica usata in tutte le forme per giustificare astrusi effetti biologici al servizio del marketing dei più vari strumenti “ad effetto quantico”.
E poi l’estrattivo ha già un suo irriducibile vantaggio(?) rispetto al sintetico: il fitocomplesso
Cordiali saluti
provo a rispondere a Robo facendo un altro esempio e riprendo anche il discorso precedente; il collega Ragaini mi ha fatto giustamente notare che avevo fatto un errore non tenendo conto che solo una parte su mille miliardi di carbonio è carbonio 14 e che le tecniche cinetiche attuali non permettono a noi uomini di discriminare se quel singolo atomo su mille miliardi è diverso o no; bene, verissimo, ho corretto; tenga conto Robo che per puro caso il veleno più potente del mondo che ho citato nel primo post la neurotossina del botulino ha una LD50 (uccide il 50% dei soggetti a cui è somministrata) alla medesima dose di una parte su 10^12 di peso corporeo (una su mille miliardi) ; in altre parole mentre il nostro organismo o meglio le sue reazioni cinetiche riescono a discriminare una parte su mille miliardi e l’organismo ci può morire addirittura (nel 50% dei casi), i nostri metodi cinetici no. In modo simile come raccontavo nel testo di oggi le piante C3 e C4 discriminano carbonio 12 e carbonio 13 in modo signiifcativo; in altri termini i sistemi biologici a differenza dell’analisi chimica di equilibrio, essendo strutture di non equilibrio, sono intrinsecamente molto più sensibili ai piccoli disturbi; questo è un criterio generale nella termodinamica irreversibile; piccole fluttuazioni in sistemi lontani dall’equilibrio possono cambiare la storia del sistema, cosa che non avviene vicino all’equiibrio. In conclusione il criterio di Born- Oppenheimer , il trascurare i nuclei (che ho citato nella prima parte), così come l’approssimazione dell’equilibrio che si fa spesso in chimica sono approssimazioni utili e potenti, ma cionondimeno SONO approssimazioni, ricordiamolo; questo è il succo dei due post. La situazione di stallo attuale nella battaglia con la chemofobia secondo dipende da questo; queste potenti approssimazioni su cui a volte insonsciamente è basata la nostra visione del mondo culturalmente, concettualmente non bastano più. Tutto qua.
Caro Della Volpe,
se a qualcuno interessa, Biofzika ha una versione in Inglese edita da Pringer (Biophysics); l’articolo citato è repreibile all’ URL: http://link.springer.com/article/10.1134/S0006350913050205.
grazie utilissimo
Pingback: L’ipotesi Siluriana. | La Chimica e la Società
Pingback: Naso e lingua sono stereoselettivi. | La Chimica e la Società
Pingback: Elementi della tavola periodica: Idrogeno, H. | La Chimica e la Società
Pingback: Acqua chirale | La Chimica e la Società