(la prima parte di questo post è pubblicata qui)
Dal 2014, la produzione di piombo è in aumento in tutto il mondo grazie al suo impiego in batterie e accumulatori. Vi sono due principali sistemi di produzione: quello primario dall’estrazione di minerali e il secondario da rottami. Nel 2014, 4,58 milioni di tonnellate provenivano dalla produzione primaria e 5,64 milioni dalla produzione secondaria. I primi tre produttori di piombo estratto in quell’anno sono stati Cina, Australia e Stati Uniti. I primi tre produttori di piombo raffinato furono Cina, Stati Uniti e India.
 Figura 7. Mappa della produzione mondiale di piombo (2016)
Figura 7. Mappa della produzione mondiale di piombo (2016)
Secondo il rapporto Metal Stocks in Society dell’International Resource Panel del 2010, la quantità totale di piombo in uso, immagazzinato, scartato o dissipato nell’ambiente, su base globale, è stata mediamente di 8 kg pro capite. Gran parte di ciò è avvenuta nei paesi più sviluppati (20-150 kg pro capite) piuttosto che in quelli meno sviluppati (1-4 kg pro capite).
I processi di produzione di piombo primario e secondario sono simili. Alcuni impianti di produzione primaria ora integrano le loro operazioni con piombo di scarto e questa tendenza è destinata ad aumentare in futuro. Utilizzando adeguate tecniche, il piombo ottenuto tramite processi secondari è indistinguibile dal piombo ottenuto tramite processi primari. I rottami di piombo del settore edile sono generalmente abbastanza puliti e vengono fusi nuovamente senza necessità di processi preventivi, sebbene a volte sia necessaria la raffinazione. La produzione secondaria di piombo è quindi più economica, in termini di fabbisogno energetico, rispetto alla produzione primaria, spesso del 50% o più.
Produzione primaria
La maggior parte dei minerali contenenti piombo ha una bassa percentuale del metallo (i minerali ricchi hanno un contenuto tipico del 3-8%), quindi devono essere concentrati prima dell’estrazione. Inizialmente, i minerali sono sottoposti a frantumazione, separazione, macinazione, galleggiamento ed essiccazione. Il materiale così concentrato, che ha un contenuto di piombo del 30–80% in massa, viene quindi trasformato in piombo metallico impuro.
Ci sono due modi principali per farlo: un processo in due fasi che prevede la torrefazione seguita dall’estrazione dall’altoforno, eseguita in recipienti separati; o un processo diretto in cui l’estrazione dal concentrato avviene in un singolo recipiente. Quest’ultima è diventata la via più comune, sebbene la prima sia ancora significativa.
Nel processo in due fasi, il concentrato di solfuro di piombo è anzitutto arrostito in aria per trasformarlo in ossido:
2PbS(s) + 3O2(g) → 2PbO (s) + 2SO2(g)↑
Poiché il concentrato originale non è costituito unicamente da solfuro di piombo, la torrefazione produce non solo l’ossido di piombo (II) desiderato, ma una miscela di ossidi, solfati e silicati di piombo e degli altri metalli contenuti nel minerale. Questo ossido di piombo impuro viene ridotto in un alto forno a coke a metallo (ancora impuro):
2PbO(s) + C(s) → 2Pb(s) + CO2(g)↑
Le impurità sono principalmente dovute ad arsenico, antimonio, bismuto, zinco, rame, argento e oro. In genere sono rimossi in una serie di processi pirometallurgici. La fusione viene trattata in una fornace a riverbero con aria, vapore e zolfo, che ossida le impurità tranne argento, oro e bismuto. I contaminanti ossidati galleggiano nella parte superiore del fuso e vengono scartati. L’argento e l’oro metallici sono rimossi e recuperati economicamente mediante il processo Parkes, in cui zinco viene aggiunto al piombo. Lo zinco, che è immiscibile nel piombo, dissolve l’argento e l’oro. La lega di zinco può essere separata dal piombo e l’argento e l’oro recuperati. Il piombo de-argentato viene liberato dal bismuto dal processo Betterton-Kroll, trattandolo con calcio metallico e magnesio. Le scorie di bismuto che ne risultano possono essere scartate.
In alternativa ai processi pirometallurgici, il piombo molto puro può essere ottenuto per via elettrolitica mediante il processo Betts. Gli anodi di piombo impuro e i catodi di piombo puro sono posti in un elettrolita di fluorosilicato di piombo (PbSiF6). Una volta applicato il potenziale elettrico, il piombo impuro sull’anodo si dissolve e si deposita sul catodo, lasciando in soluzione la maggior parte delle impurità. Si tratta di un processo ad alto costo e quindi principalmente riservato alla raffinazione di lingotti contenenti elevate percentuali di impurità.
Nel processo diretto, lingotti e scorie di piombo sono ottenuti direttamente dai minerali concentrati. Il concentrato di solfuro di piombo viene fuso in una fornace e ossidato, formando monossido di piombo. Il carbonio (come coke) viene aggiunto alla carica fusa insieme al flusso di gas di carbone (CO). Il monossido di piombo viene così ridotto a piombo metallico, in mezzo a una scoria ricca di monossido di piombo.
Se il materiale originario è ricco di piombo, fino all’80% del piombo originale può essere ottenuto come lingotti; il restante 20% forma una scoria ricca di monossido di piombo.
Processo secondario
La fusione, che è una parte essenziale della produzione primaria, è spesso saltata nella produzione secondaria. Viene eseguita solo quando il piombo metallico ha subito una significativa ossidazione. Il processo è simile a quello della produzione primaria in un altoforno o in un forno rotante, con la differenza essenziale che sta nella maggiore variabilità dei rendimenti: gli altiforni producono piombo duro (10% di antimonio) mentre i forni a riverbero e quelli rotanti producono piombo semisoft (3-4% di antimonio).
Il processo Isasmelt è un metodo di fusione più recente che è un’estensione della produzione primaria; la pasta delle batterie al piombo acido esauste (contenenti solfato di piombo e ossidi di piombo) viene rimossa dal solfato trattandola con alcali e viene quindi trattata in un forno a carbone in presenza di ossigeno, che forma piombo impuro, con antimonio come impurezza più comune. La raffinazione del piombo secondario è simile a quella del piombo primario; alcuni processi di raffinazione possono essere saltati secondo il materiale riciclato ela sua potenziale contaminazione.
Delle fonti di piombo per il riciclo, le batterie piombo-acido sono le più importanti; anche altre parti, come ad es. il tubo di piombo, la copertura e la guaina del cavo sono scarti utilizzabili.
Applicazioni e usi
Per le proprietà meccaniche, l’economicità, e la relativa inerzia chimica, il piombo è stato usato per fabbricare proiettili sin dalla loro invenzione nel Medioevo. Il suo basso punto di fusione consente di produrre munizioni per armi di piccolo calibro e pallini per fucili con attrezzature tecniche minime; ed è più denso di altri metalli comuni, il che consente una migliore ritenzione della velocità. A tutt’oggi rimane il materiale principale per fabbricare proiettili in lega con altri metalli come indurenti. Sono state tuttavia sollevate preoccupazioni sul fatto che i proiettili di piombo usati per la caccia possano danneggiare l’ambiente.
Le proprietà del piombo sono state sfruttate anche in altre numerose applicazioni. È usato come zavorra nelle chiglie delle barche a vela; la sua densità gli consente di occupare un piccolo volume e minimizzare la resistenza all’acqua, controbilanciando così l’effetto sbandante del vento sulle vele. Viene utilizzato nei pesi per le cinture delle mute per immersioni subacquee per contrastare la galleggiabilità del subacqueo. Nel 1993, la base della Torre Pendente di Pisa fu stabilizzata con 600 tonnellate di piombo. Grazie alla sua resistenza alla corrosione, il piombo è utilizzato come guaina protettiva per cavi sottomarini.
Il piombo ha molteplici usi nel settore delle costruzioni; lastre di piombo sono utilizzate nei materiali di copertura, rivestimenti, grondaie, giunti di grondaie sui parapetti dei tetti. Il piombo è ancora usato in statue e sculture. In passato era spesso utilizzato per bilanciare le ruote delle automobili; per motivi ambientali questo uso è stato gradualmente eliminato a favore di altri materiali.
Il piombo è aggiunto alle leghe di rame, ottone e bronzo per migliorarne la lavorabilità e le qualità lubrificanti. Essendo praticamente insolubile nel rame, il piombo forma globuli solidi nelle imperfezioni della lega. A basse concentrazioni, oltre a fungere da lubrificante, questi globuli impediscono la formazione di trucioli durante la lavorazione della lega, migliorando così la lavorabilità. Nei cuscinetti vengono utilizzate leghe di rame con maggiori concentrazioni di piombo. Il piombo fornisce lubrificazione e il rame fornisce il supporto portante.
L’alta densità del piombo è la base per il suo uso come barriera che assorbe il suono, le vibrazioni e le radiazioni. Il piombo ha caratteristiche meccaniche e dissipative tali che fogli di piombo vengono usati come strato fonoassorbente nelle pareti, nei pavimenti e nei soffitti degli studi di registrazione. Le canne d’organo sono spesso realizzate in una lega di piombo con quantità diverse di stagno per controllare il tono di ciascuna canna. Il piombo è un materiale ben consolidato nella protezione dalle radiazioni in radiologia e medicina nucleare grazie al suo elevato coefficiente di attenuazione.
Il principale impiego del piombo nel 20° secolo e nei primi anni del 21° secolo è nelle batterie al piombo-acido.

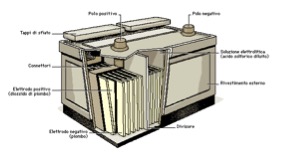 Figura8. Batteria al piombo-acido (a sinistra) e suo schema (a destra)
Figura8. Batteria al piombo-acido (a sinistra) e suo schema (a destra)
Il piombo nelle batterie non ha alcun contatto diretto con l’uomo, quindi ci sono scarsi problemi di tossicità. Tuttavia, le persone che lavorano negli impianti di produzione di queste batterie possono essere esposte alla polvere di piombo e inalarla. Le reazioni nella batteria tra piombo, il biossido di piombo e l’acido solforico forniscono una fonte affidabile di tensione. Queste batterie hanno una densità energetica e un’efficienza di scarica più basse rispetto alle batterie agli ioni di litio, ma sono notevolmente più economiche.
Il piombo è utilizzato nei cavi di alimentazione ad alta tensione come materiale di rivestimento per impedire il contatto con umidità e acqua. Questo uso sta diminuendo man mano che il piombo viene gradualmente sostituito con altri materiali. Anche il suo uso nella saldatura per l’elettronica è stato gradualmente eliminato in alcuni paesi per ridurre la quantità di rifiuti pericolosi per l’ambiente.
Le batterie al piombo-acido sono anche il principale consumatore di composti di piombo. La reazione globale di trasformazione dell’energia chimica in energia elettrica (“scarica” della batteria) è la seguente:
Pb(s) + PbO2(s) + 2H2SO4(aq) → 2PbSO4(s) + 2H2O(l)
che comporta l’uso dei due composti del piombo, biossido PbO2 e solfato PbSO4
Altre applicazioni dei composti di piombo sono altamente specifiche. Gli agenti coloranti a base di piombo sono utilizzati negli smalti ceramici e nel vetro, in particolare per le tonalità di rosso e giallo. Mentre le vernici al piombo vengono gradualmente eliminate in Europa e Nord America, rimangono in uso in paesi come la Cina, l’India, e l’Indonesia. Il tetraacetato di piombo e il biossido di piombo sono usati come agenti ossidanti in chimica organica. Il vetro al piombo è composto dal 12-28% di ossido di piombo, cambiando le sue caratteristiche ottiche e riducendo la trasmissione di radiazioni ionizzanti rispetto a un vetro normale. I semiconduttori a base di piombo come tellururo di piombo e seleniuro di piombo sono utilizzati nelle celle fotovoltaiche e nei rivelatori a infrarossi.
Tossicità
Il piombo non ha un ruolo biologico accertato e non esiste un livello sicuro confermato di esposizione. Tuttavia nel 2012, negli USA, il limite di esposizione consentito per il piombo (comprendente piombo metallico, composti di piombo inorganici e saponi al piombo) sul posto di lavoro, è stato fissato a 50 μg/m3 per un giorno lavorativo di 8 ore, e il limite per il livello di piombo nel sangue a 5 μg per 100 g.
È certa la velenosità del piombo e in particolare dei suoi composti, i suoi effetti possono danneggiare il sistema nervoso e causare malattie del cervello e del sangue. L’esposizione alla polvere di piombo, biossido di piombo PbO2 o ai suoi sali, soprattutto a quelli solubili, può causare nefropatie, caratterizzate dalla sclerotizzazione dei tessuti renali, e dolori addominali colici. Nefropatie croniche ed encefalopatie sono state rilevate in forti bevitori di superalcoolici fatti in casa o di contrabbando, perché la saldatura della caldaia e quella delle serpentine di distillazione è realizzata in piombo. Talvolta è capitato che i sali di piombo usati negli smalti per vasellame abbiano causato degli avvelenamenti a causa del contatto con bevande particolarmente acide (come certi succhi di frutta) che estraggono ioni piombo dallo smalto. Si pensa che fosse questa la causa delle coliche del Devon, una contea del Regno Unito, dove si usavano presse con parti di piombo per estrarre il succo di mela e farne sidro.
Altre categorie a rischio di intossicazione sono i lavoratori dell’industria e dell’artigianato.
Per quanto riguarda il metabolismo cellulare, il piombo può inibire alcuni enzimi agendo sui gruppi solfidrilici liberi impedendo che possano essere utilizzati da enzimi cui sono indispensabili.
Le preoccupazioni per il ruolo del piombo nel ritardo mentale nei bambini hanno portato a una generale riduzione del suo uso. Le vernici contenenti piombo sono state ritirate dal commercio in tutti i paesi industrializzati, tuttavia molte vecchie case contengono ancora piombo nelle loro vernici e in caso di lavori di ristrutturazione non si dovrebbero mai aggiungere ai vecchi strati di vernice carta da parati perché si potrebbero formare polveri sottili contenenti piombo che finirebbero per essere respirate.
Inquinamento
L’estrazione, la produzione, l’uso e lo smaltimento del piombo e dei suoi prodotti hanno causato una contaminazione significativa dei suoli e delle acque della Terra. Le emissioni atmosferiche di piombo ebbero il culmine durante la rivoluzione industriale e il periodo della benzina al piombo tetraetile nella seconda metà del XX secolo. I rilasci di piombo provengono da fonti naturali, produzione industriale, incenerimento e riciclaggio e mobilizzazione di piombo precedentemente sepolto. Concentrazioni elevate di piombo persistono nei suoli e nei sedimenti nelle aree postindustriali e urbane; le emissioni industriali, comprese quelle derivanti dalla combustione del carbone, continuano in molte parti del mondo, in particolare nei paesi in via di sviluppo.
Il piombo può accumularsi nei suoli, in particolare quelli con un alto contenuto organico, dove rimane per centinaia o migliaia di anni. Il piombo ambientale può competere con altri metalli presenti nelle e sulle superfici delle piante inibendo potenzialmente la fotosintesi e, a concentrazioni sufficientemente elevate, influenzando negativamente la crescita e la sopravvivenza delle piante. La contaminazione di suoli e piante può, attraverso la catena alimentare, intossicare dai microrganismi agli animali. Negli animali, il piombo presenta tossicità in molti organi, danneggiando i sistemi nervoso, renale, riproduttivo, ematopoietico e cardiovascolare dopo ingestione, inalazione o assorbimento cutaneo. Nelle acque inquinate, il piombo si trova sia in soluzione sia nei sedimenti. Anche in questo caso, attraverso la catena alimentare, la contaminazione può raggiungere pesci, uccelli e mammiferi marini.
Un importante test sui biomarcatori per l’avvelenamento da piombo sono i livelli di acido δ-aminolevulinico nel plasma, nel siero e nelle urine.
Riciclaggio e rimozione
Il piombo è tra i materiali più riciclati in termini di tasso di recupero. Può essere rifuso indefinitamente per rimuovere le impurità. Le sue proprietà fondamentali lo rendono facilmente identificabile ed economico da raccogliere a scopo di riciclaggio. Si valuta che oltre il 50% del piombo utilizzato al mondo nella produzione di nuovi prodotti provenga da quello riciclato. Poiché la qualità del piombo riciclato è quasi identica a quella del piombo primario, il suo valore e la sua domanda sono molto elevati.
Attualmente, oltre l’85% viene utilizzato nella produzione di batterie al piombo, quasi il totale di tale quantità è facilmente recuperabile e riciclabile. Nel 2013, la produzione mondiale di piombo riciclato era di 6,7 milioni di tonnellate, pari al 54% della produzione globale. Tutto il piombo prodotto negli Stati Uniti e il 74% del piombo prodotto in Europa proviene da materiale riciclato. L’attuale tasso di riciclaggio del piombo in Nord America ed Europa è di quasi il 99%.
Secondo EUROBAT[1] e Battery Council International (BCI)[2] la batteria al piombo è il prodotto di consumo più riciclato al mondo.
Oggetti e manufatti non più utilizzati in piombo vengono resi ai rivenditori di metalli, ai negozi di bricolage, alle aziende di riciclaggio, alle officine automobilistiche e ai rivenditori di accessori per auto che li inviano a punti di raccolta dedicati. Tutto questo materiale viene in generale rifuso; il piombo residuo è quindi raccolto da società specializzate che impiegano in generale il processo secondario.
Il recupero e il riciclaggio del piombo hanno grandi vantaggi ambientali. Il riciclo riduce il rilascio di piombo nell’ambiente e conserva le risorse naturali, inoltre l’uso di piombo riciclato nella produzione di nuovi prodotti è altamente efficiente dal punto di vista energetico. La produzione di piombo riciclato richiede solo dal 35 al 40% dell’energia necessaria per produrre piombo primario dal minerale.
Infine, sono state condotte ricerche su come rimuovere il piombo dai biosistemi con mezzi biologici: si stanno studiando le lische di pesce per la loro capacità di assorbire il piombo nel suolo contaminato. Il fungo Aspergillus versicolor è efficace per assorbire gli ioni di piombo dai rifiuti industriali prima di essere rilasciato nelle acque. Numerosi batteri sono stati studiati per la loro capacità di rimuovere il piombo dall’ambiente, inclusi i batteri che riducono i solfati: Desulfovibrio e Desulfotomaculum, entrambi i quali sono risultati altamente efficaci in soluzioni acquose.
Ciclo biogeochimico
In figura è rappresentato un diagramma di tale ciclo, tratto da [1].
 Figura 9. Diagramma del ciclo biogeochimico del piombo
Figura 9. Diagramma del ciclo biogeochimico del piombo
Il significato generale del diagramma è stato illustrato nel post sul silicio https://ilblogdellasci.wordpress.com/2019/08/14/elementi-della-tavola-periodica-silicio-si/
Nel caso specifico del piombo, l’uso indiscriminato dell’ossido come pigmento bianco in edilizia e del piombo tetraetile come additivo per la benzina degli autoveicoli ha causato una dispersione del piombo diffusa in tutta la biosfera, in misura maggiore della dispersione dovuta al ciclo naturale.
La figura mostra che l’emissione di piombo da parte delle attività umane è un ordine di grandezza superiore a quella dovuta al ciclo naturale.
Desidero infine ribadire che poiché l’impatto delle attività antropogeniche può alterarli, lo studio dei cicli biogeochimici degli elementi è oggetto di continui aggiornamenti e revisioni.
Opere consultate
CRC, Handbook of Chemistry and Physics, 85th, p. 4-18
https://en.wikipedia.org/wiki/Lead
Bibliografia
[1] V. Cilek (a cura di), Earth System: History and Natural Variability – Volume IV, UNESCO-EOLSS, 2009, pp. 238-239.
[1] EUROBAT è l’associazione dei fabbricanti europei di batterie per autoveicoli e usi industriali.
[2] Battery Council International è un’associazione internazionale di fabbriche di batterie per auto con sede a Chicago, USA.


Caro collega,
non sono particolarmente esperto di chimica del piombo e/o delle sue applicazioni, ho imparato oggi cose che mi saranno utili lnella preparazione di lezioni. Grazie !
Mancano però nel tuo articolo cenni all’uso dell’ ossido di piombo nei vetri, i cosiddetti “cristalli”, ad alto indice di rifrazione. Ricordo etichette nelle quali veniva garantito (per fregiarsi del titolo di “Cristallo”) un contenuto minimo di Pb del 24%.
Il risultato è che ora i bicchieri di cristallo (ma anche i lampadari !) son ritenuti rifiuti pericolosi e devono essere conferiti all’ecocentro per discariche speciali.
Domanda : quanto può essere il rilascio di Pb(II) o Pb(IV) da un vetro del genere ? Io sono francamente perplesso, è difficile immaginare intossicazioni da Pb nei bevitori da questi contenitori…la sua sostituzione (appresa dalla rete) con Ba(II) mi lascia, a dire la verità, molto perplesso. Penso che i decessi/danni da Pb siano molto più frequenti per le pallottole che per altre applicazioni…
Voi cosa ne sapete ?
Grazie,
Stefano Antoniutti
Pingback: Elementi della tavola periodica: Piombo, Pb. 3. Origine del piombo. | La Chimica e la Società
“I Piombi” era il nome delle carceri di Venezia che avevano la copertura del tetto in questo materiale resistente alle nebbie salmastre della laguna. Tanti celebri personaggi vi furono rinchiusi, tra essi il più famoso sicuramente è Casanova.
Dov’è il terzo commento, che non riesco a visualizzare ?
antoniutti