Claudio Della Volpe
(per i precedenti articoli di questa serie vedi in fondo)
L’”acqua micellare” è uno dei prodotti di maggior successo pubblicitario degli ultimi tempi; il suo mercato dominante sono le donne che se si truccano poi si struccano ( a questo serve l’acqua micellare, a ripulire la pelle), una attività che in realtà risale a tempi immemorabili; certo la pubblicità e il mercato hanno spinto sul filone della bellezza femminile e non, ma il trucco femminile e anche maschile è una tradizione culturale che risale alle origini della nostra specie e si coniuga con aspetti sociali e sessuali, ma anche religiosi. La caverna di Blombos in sud Africa che testimonia attività di tipo chimico di Homo Sapiens e di cui abbiamo parlato in uno dei primi post pubblicati su questo blog, risale a 100.000 anni fa e vi si producevano, guarda un po’, polveri colorate per scopi analoghi.
Dunque non mi scandalizzo affatto che esistano prodotti del genere; qua si tratta solo di capire di cosa stiamo parlando esattamente. Ha senso questa definizione e a cosa si riferisce esattamente? Cosa è l’acqua micellare?
L’acqua micellare si presenta come una soluzione limpida ma contenente sia componenti acquose che idrofobiche, come l’olio di ricino (si veda più avanti per la formula completa di uno dei tanti prodotti commerciali); ne segue che abbiamo qui qualcosa di simile ad una emulsione, ma a differenza delle normali emulsioni tipo acqua-sapone ed eventualmente olio che sono opache o tendono comunque a diffondere la luce, questa non la diffonde.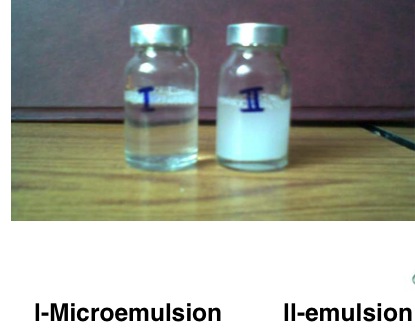
Come mai?
Sembra che il primo prodotto di questa classe sia stato fatto in casa ed usato come detergente della lana dalle donne australiane fin dall’inizio del XIX secolo; se mescolate nelle giuste proporzioni acqua/olio di eucalipto/sapone in scaglie e una miscela del cosiddetto spirito bianco, un distillato del petrolio ottenete una emulsione di questo medesimo genere, stabile e trasparente; analogamente la ricetta di Bosisto per lavare la lana è costituita da
scaglie di sapone 300g/spirito metilato (ossia 95% di alcool etilico e 5% di metilico) 200ml agitare bene; miscelare con 50ml di olio di Eucalipto; conservare la pasta che viene fuori e aggiungere poca acqua calda quanto basta al momento del lavaggio; poi aggiungete all’acqua di lavaggio totale.
Dopo avere strizzato i panni avvolti in un tessuto fateli asciugare senza esporli alla luce.
Cosa avete ottenuto con quella miscela e perché il prodotto finale è trasparente e stabile?
Si tratta delle cosiddette microemulsioni, scoperte ufficialmente solo nel 1943 da Hoar and Schulman mescolando una soluzione lattescente con esanolo per produrre una soluzione uniforme, una fase singola e non conduttiva.
Come potete leggere nel testo il fenomeno, dicono gli autori, era già ben conosciuto. La prima applicazione commerciale delle microemulsioni o delle “idromicelle oleopatiche”, fu infatti costituita dalle cosiddette cere liquide , brevettate da Rodawald nel 1928.
da Microemulsions Theory and Practice a cura di Leon Prince
Nella tabella sottostante vedete le differenze fra i due tipi di emulsioni:
Una rappresentazione più grafica delle differenze in cui è introdotto anche il caso intermedio della nanoemulsioni, (non fatevi confondere dal nome, le nanoemulsioni sono a micelle più grandi della microemulsioni, scherzi della lingua).
Si tratta dunque di micelle, gocce di diametro piccolo di una fase circondate da uno strato di molecole di tensioattivo ben orientate più piccole delle altre; la fase esterna o interna può essere acquosa mentre l’altra è oleosa e viceversa. Il diametro così piccolo delle microemulsioni è dovuto alla particolare geometria dei tensioattivi usati e dei co-tensioattivi, ossia le altre molecole, alcooli per esempio, che consentono di creare una forte curvatura e di rafforzarla, rendendole stabili nel tempo.
Questo giustifica la trasparenza, poichè il diametro delle micelle non consente la diffusione laterale della luce e anche il fatto che le soluzioni ottenute siano stabili, mentre sia le emulsioni normali che le cosiddette nanoemulsioni non lo sono.
Come si spiegano quantitativamente le differenze di comportamento fra i vari tipi di emulsioni? La teoria base fu sviluppata da Eli Ruckenstein negli anni 70 ed è esemplificata dal seguente grafico che vado a commentare, tratto da un classico della letteratura della termodinamica superficiale (J. Chem. Soc., Faraday Trans. 2, 1975,71, 1690-1707); Ruckenstein è stato uno dei maggiori teorici delle soluzioni e delle interfacce e forse è poco ricordato, ma molte teorie affascinanti sono dovute a lui; l’ho conosciuto di persona nel 2000 a Princeton, in un congresso dove presentavo una serie di misure che supportavano una delle sue teorie sul fenomeno della rottura dei film superficiali, fenomeno che poi ha trovato applicazione nell’industria dei detergenti (avete notato che quando lavate l’auto alla pompa usate due detergenti diversi? Uno è il solito anionico per togliere lo sporco, l’altro è un cationico che serve invece a togliere via l’acqua di lavaggio, è un rinsing aid in inglese; la teoria sui rinsing aids è di Ruckenstein). Ruckenstein era seduto in prima fila e mi fece anche una domanda; la cosa mi emozionò parecchio.
In questo grafico si confrontano le energie libere superficiali delle micelle contro la loro dimensione per alcuni casi chiave, ottenuti sommando i contributi delle varie componenti :formazione della microemulsione, aumento dell’area totale, interazione fra le micelle, adsorbimento del tensioattivo ed entropia legata alla dispersione dellla fase oleosa nelle micelle. Questi 5 termini variano al variare del diametro della micella e dunque la somma complessiva.
Per i casi C e D l’energia libera è sempre positiva per cui si possono formare solo emulsioni che non sono termodinamicamente stabili. Nel caso C che mostra un massimo relativo si possono ottenere emulsioni cineticamente stabili, ossia che si possono destabilizzare se in qualche modo il sistema può superare la barriera di energia potenziale (per esempio aumentando la temperatura) ma che rimangono stabili solo se la barrriera è sufficientemente grande. Per i casi A e B invece la energia libera è negativa in certi valori del raggio o anche sempre. Questo vuol dire che una dispersione di micelle aventi un raggio in questo intervallo è stabile rispetto alla separazione di fase e dunque si formerà una microemulsione stabile; ovviamente per il raggio R* la microemulsione presenterà la situazione di massima stabilità.
Giusto per fare un esempio di separazione di fase si pensi all’impazzimento della maionese; quello è un esempio di separazione di fase, mentre la maionese ben riuscita è una emulsione stabile (cineticamente , non è una microemulsione).
Qui sotto la composizione di una specifica acqua micellare:
aqua; poloxamer 184; disodium phosphate; hexylene glycol; hamamelis virginiana water; phenoxyethanol; benzyl alcohol; disodium cocoamphodiacetate; potassium phosphate; sodium chloride; parfum; peg-40 hydrogenated castor oil (olio di ricino); limonene;
Il poloxamer 184 è il tensioattivo non ionico, coadiuvato dal glicole, dall’alcol benzilico e dal cocoamfodiacetato, che aiutano a forzare il raggio delle micelle; l’olio di ricino è la componente oleosa che aiuta invece a eliminare il trucco. Gli altri componenti servono essenzialmente a proprietà estetiche come il profumo, ma notate che possono questi avere anche proprietà allergizzanti.
Aggiungo che le microemulsioni hanno molte applicazioni in campo medico e biologico. Ma ne parleremo un’altra volta.
 Venus è un marchio della Kelemata-Perlier, una azienda Italiana, fondata nel 1919 dalla famiglia Giraudi, con un fatturato attale di circa 80 milioni di euro e proprietaria di parecchi marchi. Nel 2013 aveva poco più di 200 dipendenti.
Venus è un marchio della Kelemata-Perlier, una azienda Italiana, fondata nel 1919 dalla famiglia Giraudi, con un fatturato attale di circa 80 milioni di euro e proprietaria di parecchi marchi. Nel 2013 aveva poco più di 200 dipendenti.
Colgate-Palmolive invece è una grandissima multinazionale americana fondata nel 1953 che ha un fatturato di 20 miliardi di dollari e 37000 dipendenti.
La storia dei brevetti su questo tema è troppo intricata per farne una sia pur breve lista; Kelemata non appare detenere brevetti specifici, dunque probabilmente produce su licenza (mi farebbe piacere saperlo).
Esistono molti altri prodotti analoghi in commercio; ho riportato l’esempio anche perchè questo mi appare uno dei pochi produttori italiani di microemulsioni cosmetiche; è da dire che esistono molte altre applicazioni nel campo della detergenza, basate su microemulsioni formulate anche da piccole aziende.
Riferimenti.
J.H. Schulman, W. Stoeckenius, L.M. Prince,
Mechanism of formation and structure of micro emulsions by electron microscopy, J. Phys. Chem. 63 (1959) 1677–1680
HOAR, T. P., & SCHULMAN, J. H. (1943). Transparent Water-in-Oil Dispersions: the Oleopathic Hydro-Micelle. Nature, 152(3847), 102–103. doi:10.1038/152102a0
Microemulsion vs. nanoemulsion Devesh Kumar Jain – SlideShare
https://patentimages.storage.googleapis.com/bd/ad/cd/18969d516e71b1/US5874393.pdf
https://ilblogdellasci.wordpress.com/2016/12/21/la-chimica-della-pubblicita-prodotti-per-la-rasatura
https://ilblogdellasci.wordpress.com/2016/12/16/le-molecole-della-pubblicita-lanticalcare-2/
Le molecole della pubblicità: la biogenina e i suoi discendenti.
https://ilblogdellasci.wordpress.com/2016/11/20/la-chimica-della-pubblicita-lacchiappacolore/
https://ilblogdellasci.wordpress.com/2016/10/24/le-molecole-della-pubblicita-2c/


Caro Claudio,
Beatrice Mautino, laureata in Biotecnologie e divulgatrice scientifica, al recente convegno della Divisione di Chimica Organica della SCI svoltosi a Milano ha tenuto una conferenza sull’argomento. Lei è autrice del libro “Il trucco c’è e si vede” https://books.google.it/books/about/Il_trucco_c_%C3%A8_e_si_vede.html?id=xTJDDwAAQBAJ&printsec=frontcover&source=kp_read_button&redir_esc=y#v=onepage&q&f=false
Io non ho potuto ascoltarla per la concomitanza con un’altra sessione, ma mi hanno detto che è stata molto interessante ed ha parlato anche dell’acqua micellare.
Che dire? Al solito ci parliamo tra noi…
Grazie comunque.
Lucio
Pingback: Le figure chimico-retoriche (in pubblicità). | La Chimica e la Società
Solo un appunto sulla fase oleosa… L’inci corretto è peg40 hydrogenated castor oil e si tratta di un tensioattivo, non di un olio che disperde il trucco. Si usa Come solubilizzante delle fragranze in acqua.
mi spiace avevo copiato da una fonte che conteneva il punto e virgola; correggo