Rinaldo Cervellati
 Lo Zinco (Zn) è l’elemento n. 30 della Tavola Periodica, il ventitreesimo elemento più abbondante nella crosta terrestre. L’origine del suo nome è oscura ma è certo che era riconosciuto come metallo a se stante centinaia di secoli a. C., e i suoi minerali erano usati per la fabbricazione dell’ottone. Nel libro della Genesi viene menzionato Tubal-cain, discendente di settima generazione da Adamo, come dotato di una reale maestria nella lavorazione dei metalli [1]. T.C. Mitchell [2] sostiene che egli scoprì la possibilità di fucinatura a freddo e di bombatura del ferro meteorico. Tubal-cain è stato descritto anche come il primo chimico [3]. Un fatto certo è che una lega contenente l’87% di zinco è stata trovata in rovine preistoriche in Transilvania e che zinco metallico è stato prodotto nel 13° secolo a.C. in India riducendo il minerale calamina (figura 1) con sostanze organiche come la lana [1].
Lo Zinco (Zn) è l’elemento n. 30 della Tavola Periodica, il ventitreesimo elemento più abbondante nella crosta terrestre. L’origine del suo nome è oscura ma è certo che era riconosciuto come metallo a se stante centinaia di secoli a. C., e i suoi minerali erano usati per la fabbricazione dell’ottone. Nel libro della Genesi viene menzionato Tubal-cain, discendente di settima generazione da Adamo, come dotato di una reale maestria nella lavorazione dei metalli [1]. T.C. Mitchell [2] sostiene che egli scoprì la possibilità di fucinatura a freddo e di bombatura del ferro meteorico. Tubal-cain è stato descritto anche come il primo chimico [3]. Un fatto certo è che una lega contenente l’87% di zinco è stata trovata in rovine preistoriche in Transilvania e che zinco metallico è stato prodotto nel 13° secolo a.C. in India riducendo il minerale calamina (figura 1) con sostanze organiche come la lana [1].

Figura 1 Calamina zinco metallo in lastra
Il metallo fu riscoperto in Europa da Andreas Sigismund Marggraf[1] nel 1746, riducendo il minerale calamina (un miscuglio di silicato idrato di zinco e carbonato di zinco) con carbone.
Oltre alla calamina, principali minerali dello zinco sono sfalerite o blenda (solfuro di zinco e ferro), smithsonite (carbonato) e franklinite (ossido misto di ferro, zinco e manganese). In seguito a processi geologici e chimici, lo zinco si è concentrato a livelli particolarmente elevati in certi luoghi del pianeta piuttosto che in altri. Il minerale può essere estratto da queste zone quando la concentrazione di zinco supera il 5%. Le aree più ricche di zinco si trovano principalmente in Nord e Sud America, Australia, Asia e, in misura minore, in Europa.
Le risorse minerarie sono stimate a circa 220 milioni di tonnellate di riserve di zinco attualmente sfruttabili. Il consumo mondiale annuo di zinco è attualmente di circa 9,7 milioni di tonnellate. Poiché il riciclaggio rappresenta circa il 39% del consumo di zinco, le riserve si esaurirebbero a un tasso annuo di 5,9 milioni di tonnellate. L’aumento del riciclaggio compenserà la crescita futura dei consumi. Sulla base del consumo costante e senza ipotizzare futuri successi esplorativi, le riserve di zinco sfruttabili dureranno per un periodo di circa 55 anni. Tuttavia, se si aggiungono le riserve di minerale potenzialmente disponibili in futuro, le risorse totali sono stimate in 1.900 milioni di tonnellate, un valore che soddisferebbe il fabbisogno di zinco per diversi secoli all’attuale tasso di estrazione annuale [4,5].
Lo zinco può essere ottenuto mediante arrostimento dei suoi minerali con formazioni di ossido e successiva riduzione dell’ossido di zinco con carbone (ZnO + C → Zn + CO), seguita da distillazione del metallo alla temperatura di 750 °C. Un altro metodo di estrazione è quello per via elettrolitica. Dopo aver ottenuto l’ossido dal minerale, è trattato con acido solforico e la soluzione risultante è inviata a una cella elettrolitica con anodo costituito da una lastra di piombo e catodo da una lastra di zinco puro, la reazione complessiva è:
ZnSO4 + H2O → Zn + H2SO4 + 1/2O2
Si ottengono così catodi di zinco puro.
Lo zinco è al quarto posto fra i metalli più utilizzati al mondo, preceduto nell’ordine da ferro, allumino e rame. La quantità di energia necessaria per produrre zinco dai suoi minerali è bassa rispetto all’energia necessaria per produrre altri metalli non ferrosi (alluminio, rame) utilizzati in edilizia, come mostra il seguente grafico, tratto da [4]: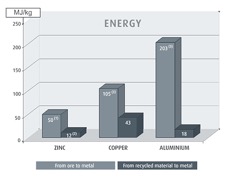
Ancor meno energia è necessaria per produrre zinco per riciclaggio.
Lo zinco presente in natura contiene cinque isotopi stabili.
Lo zinco è un metallo bianco-azzurrognolo, brillante che esposto all’atmosfera si ricopre più o meno lentamente di una patina bianca. È questa patina che conferisce allo zinco la sua lunga durabilità. La superficie di zinco metallico reagisce infatti con l’ossigeno atmosferico (O2) in presenza di acqua (H2O) per formare idrossido di zinco (Zn(OH)2). L’idrossido di zinco reagisce con il biossido di carbonio atmosferico (CO2) per formare idrossicarbonato di zinco (2ZnCO3.3Zn(OH)2) che è il componente principale della patina (figura 2).
 Figura 2 Formazione della patina protettiva, tratta da [4]
Figura 2 Formazione della patina protettiva, tratta da [4]
Lo zinco è fragile a temperature ordinarie ma malleabile a 100-150°C. È un buon conduttore di elettricità e brucia in aria al calor rosso con sviluppo di nuvole bianche dell’ossido.
Lo zinco metallico ha moltissimi impieghi industriali, dalla galvanizzazione di metalli per prevenirne l’ossidazione (grondaie), alle zamak (leghe a base di Zinco, Alluminio, Magnesio, Antimonio e Rame) usate nella produzione di parti di autoveicoli, pannelli solari, elettrodomestici, giocattoli, bottoni e cerniere. Alcune grondaie in lega di zinco possono durare fino a 100 anni perché la patina è insolubile in acqua, impedendo ogni ulteriore reazione con ossigeno e CO2[2]. Cilindretti di zinco sono usati come contenitore (e polo negativo) nelle pile Leclanché (zinco-carbone). Lo zinco è anche usato in lega per la fabbricazione di oggetti di oreficeria e argenteria. Leghe molto importanti sono l’ottone (Zn-Cu), il bronzo commerciale (Cu 90%, Zn 10%), l’alpaca o argento tedesco (Zn-Cu-Ni), e la lega con alluminio < 5% da fonderia. Grandi quantità di zinco servono a produrre pressofusi, ampiamente utilizzati dalle industrie automobilistica, elettrica e informatica. I composti organometallici dello zinco sono usati nella sintesi di numerose sostanze organiche.
Una lega denominata Prestal®, costituita da zinco al 78% e il 22% di alluminio è quasi forte come l’acciaio, ma è facile da modellare quanto la plastica (superplasticità). Il Prestal® è così plastico da poter essere modellato in forma di pressofusi relativamente poco costosi.
Secondo una statistica del 2016 (US Geological Survey), i dieci Paesi con la produzione maggiore di zinco sono stati: Cina (4.5 milioni tonnellate), Perù (1.3), Australia (0.85), USA (0.78), Messico (0.71), India (0.65), Bolivia (0.46), Kazakistan (0.44), Canada (0.31) e Svezia (0.25).
La Cina è dunque il più grande paese produttore a livello mondiale e un importante consumatore del metallo. I consumi cinesi sono stati la causa principale della rapida crescita dei prezzi.
Lo zinco è potenzialmente riciclabile al 100%. Una stima afferma che il 60% dello zinco disponibile a fine vita è recuperata ed effettivamente riciclata [4,6]. In Europa, il 95% del laminato di zinco usato è riciclato. Il successo del riciclaggio dello zinco laminato è dovuto a un mercato molto ben organizzato (figura 3):
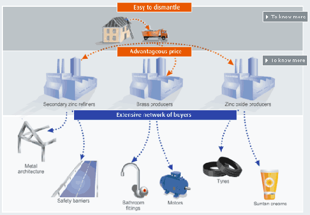 Figura 3 Riciclaggio dello zinco, tratta da [4]
Figura 3 Riciclaggio dello zinco, tratta da [4]
Lavorati contenenti zinco come ferro o acciaio zincato possono diventare una fonte di materiali per il riciclaggio alla fine delle loro vite utili (“vecchi rottami”). Questi materiali sono raccolti e processati in base alla loro composizione (quantità dello zinco e degli altri metalli nella lega) e facilità di elaborazione. Inoltre, a causa di potenziali perdite durante la fabbricazione e la lavorazione (ad esempio, scorie, residui, scarti, ecc.), una certa quantità di zinco diventa disponibile per il riciclaggio già durante la fase di lavorazione stessa (“nuovo rottame”).
Secondo la composizione del rottame, il riciclaggio può avvenire per ri-fusione o rimandato direttamente al processo di raffinazione [6].
Lo zinco ha un solo numero di ossidazione, 2+, quindi il suo ossido è ZnO. Di questo importantissimo composto abbiamo parlato in un precedente post
(https://ilblogdellasci.wordpress.com/2016/02/29/zinco-e-ossido-di-zinco-una-riscoperta/)
che contiene anche una satirica clip tratta dal film Ridere per ridere di John Landis (1977). Vale comunque la pena ricordare che l’ossido di zinco contenuto nelle preparazioni farmaceutiche, igieniche e cosmetiche non può essere riciclato.
Lo zinco è un elemento fondamentale per la vita animale (esseri umani compresi) e vegetale.
Esiste un intervallo di concentrazione di zinco ottimale per ciascun organismo vivente. All’interno di questo intervallo gli organismi viventi possono regolare la loro concentrazione interna per soddisfare i requisiti metabolici (figura 4).
 Figura 4 Salute e apporto di zinco,tratta da [4]
Figura 4 Salute e apporto di zinco,tratta da [4]
Lo zinco è un importante oligoelemento per gli esseri umani in quanto occupa il 3° posto, dopo il magnesio e il ferro. È essenziale per la crescita, lo sviluppo del cervello, la protezione della pelle, il corretto funzionamento del sistema immunitario, la digestione, la riproduzione, il gusto, l’olfatto e molti altri processi fisiologici. Il corpo umano non è in grado di sintetizzare lo zinco di cui ha bisogno, deve quindi introdurlo con l’alimentazione. Cereali, legumi, frutta secca, uova, latticini e carni rosse sono alcuni dei cibi più ricchi in zinco.
L’Organizzazione mondiale della sanità (OMS) raccomanda un apporto giornaliero di 10 mg/giorno per i bambini, 12 mg/giorno per le donne e 15 mg/giorno per gli uomini. Alcuni gruppi di popolazione hanno un fabbisogno di zinco più elevato e pertanto sono più a rischio di carenza di zinco: bambini e adolescenti, donne incinte, sportivi, anziani, ecc. Se queste condizioni ottimali non sono soddisfatte e vi è un deficit può verificarsi una carenza.
I sintomi legati a una carenza di zinco sono: riduzione dei sensi di gusto e olfatto, problemi della pelle, letargia mentale e riduzione della fertilità.
La varietà nella dieta di una persona dipende principalmente da fattori culturali e socio-economici. Poiché la quantità di zinco varia secondo il tipo di alimentazione, su scala globale molti adulti e bambini ne assumono troppo poco. Nei paesi in via di sviluppo, la carenza di zinco è al quinto posto tra i primi 10 fattori di rischio per la salute umana; l’OMS ha stimato circa 800.000 morti l’anno per carenza di zinco [4].
A differenza degli esseri umani gli ecosistemi sono raramente soggetti a una mancanza di zinco, ma possono essere sottoposti a un eccesso.
Come mostrato in figura 5 lo zinco è naturalmente presente nell’ambiente: rocce, suolo, acqua e aria hanno sempre contenuto naturalmente concentrazioni variabili di esso.
 Figura 5 Intervalli conc. Zn in diversi ecosistemi, tratta da [4]
Figura 5 Intervalli conc. Zn in diversi ecosistemi, tratta da [4]
Nel corso della loro evoluzione, tutti gli organismi viventi hanno utilizzato lo zinco disponibile nel loro ambiente per specifiche funzioni del loro metabolismo, adattandosi alla concentrazione naturale di zinco nel loro ecosistema. Inoltre, hanno sviluppato meccanismi per mantenere condizioni di vita ottimali quando questo livello di concentrazione dovesse variare di poco dalla norma. Ma se la concentrazione di zinco cambia radicalmente, le condizioni di vita non sono più ottimali e il funzionamento dell’ecosistema viene alterato. Per questo motivo vengono condotti studi ecotossicologici per valutare il rischio per l’ambiente di un eccesso di zinco.
In questi studi è presa in considerazione solo la concentrazione di zinco disciolto perché la parte insolubile non ha alcun effetto su di essi. La concentrazione di zinco disciolto è influenzata dalle proprietà dell’ambiente quali pH, durezza dell’acqua, carbonio organico disciolto e temperatura. Pertanto, qualsiasi studio sull’impatto ambientale dello zinco deve tenere conto delle caratteristiche specifiche dell’ecosistema in questione e della concentrazione di zinco disciolto, non della concentrazione totale.
Studi ecotossicologici hanno dimostrato che le concentrazioni di zinco negli ecosistemi europei, originate da attività umane (come la corrosione atmosferica di zinco laminato e acciaio zincato, usura di pneumatici di veicoli, fertilizzanti e alimenti per animali, ecc.) o emissioni naturali (principalmente da attività vulcanica), rimangono fortunatamente per ora nei limiti delle condizioni di vita ottimali.
Bibliografia
[1] CRC, Handbook of Chemistry and Physics, 85th, p. 4-35
[2] T. C. Mitchell, Tubal-cain, in New Bible Dictionary (IVF, 1962), 1302.
[3] Tubal-Cain Acclaimed as Pioneer Chemist, in The Science News-Letter, Society for Science & the Public, 30 agosto 1941, p. 142,
[6] IZA (International Zinc Association),
[1] Andreas Sigismund Marggraf (1709-1782) chimico prussiano, allievo di Caspar Neumann discepolo di Stahl, assistente del chimico Spielmann, seguì le lezioni di Friedrich Hoffmann e di Johann Juncker. Nel 1734 si recò a Freiberg in Sassonia per studiare metallurgia con Henckel. Fu poi direttore del Laboratorio Chimico dell’Accademia Prussiana delle Scienze e della Classe di Filosofia Sperimentale della stessa Accademia. Aderì alla teoria del flogisto di Stahl-Juncker ma il suo profondo interesse per la scienza chimica, il perfezionamento di strumenti analitici e l’uso della bilancia anticiparono alcuni aspetti della rivoluzione chimica lavoisierana. https://www.encyclopedia.com/people/science-and-technology/chemistry-biographies/andreas-marggraf
[2] La durata dello zinco può essere ridotta da alcuni inquinanti acidi, che aumentano il tasso di corrosione. Il principale inquinante è il biossido di zolfo (SO2) che reagisce con la patina formando solfato di zinco, che è solubile in acqua e corrosivo. Il biossido di zolfo è emesso da alcuni impianti industriali, impianti di riscaldamento centralizzati a olio e traffico stradale. Di conseguenza, il tasso di corrosione è maggiore in aree urbane o industrializzate rispetto a un ambiente rurale.
